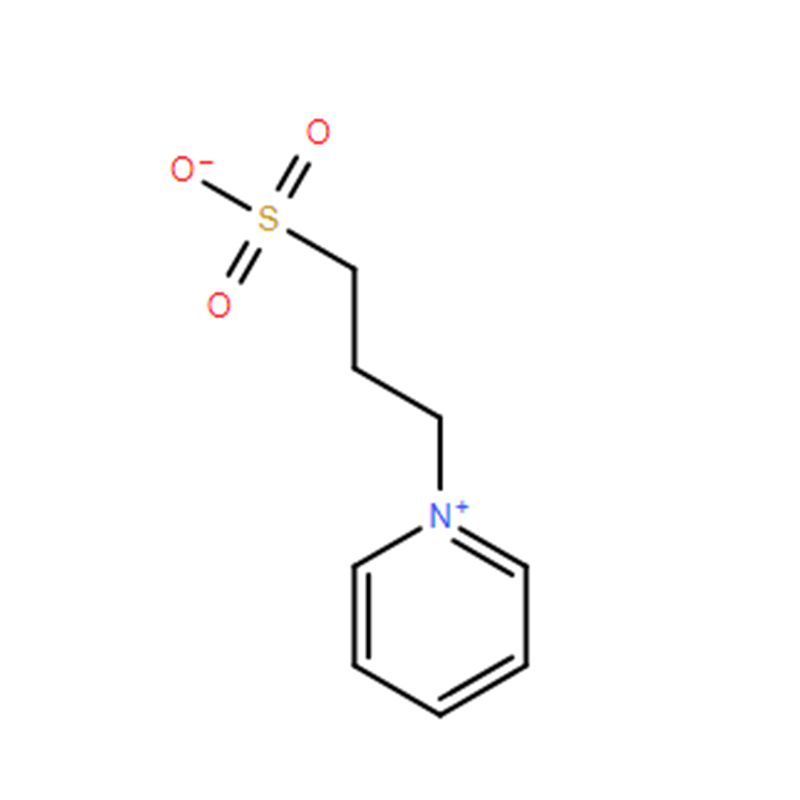
3-(1-Pyridinio)-1-propansulfonat Cas: 15471-17-7 99 % weißes Pulver
| Katalognummer | XD90192 |
| Produktname | 3-(1-Pyridinio)-1-propansulfonat |
| CAS | 15471-17-7 |
| Molekularformel | C8H11NO3S |
| Molekulargewicht | 201.24 |
| Speicherdetails | 0 bis 8°C |
| Harmonisierter Tarifkodex | 29333990 |
Produktspezifikation
| Aussehen | weißes Puder |
| Test | 99 % |
Die Proteinphosphorylierung reguliert verschiedene Zellfunktionen und spielt eine Schlüsselrolle in der frühen Entwicklung von Pflanzen.Um frühere Untersuchungen zur Proteinphosphorylierung in Arabidopsis-Sämlingen zu ergänzen und zu erweitern, verwendeten wir einen alternativen Ansatz, der die Proteinextraktion unter nicht denaturierenden Bedingungen mit der Anreicherung intakter Phosphoproteine in Rubisco-abgereicherten Extrakten durch immobilisierte Metallionenaffinitätschromatographie (IMAC) und anschließende Identifizierung kombiniert unter Verwendung zweidimensionaler Gelelektrophorese (2-DE) und Flüssigkeitschromatographie-Tandem-Massenspektrometrie (LC-MS/MS).Der Trypsinverdau im Gel und die Analyse ausgewählter Gelflecken identifizierten 144 phosphorylierte Peptide und Rückstände, von denen nur 18 Phosphopeptide und 8 Phosphosites in den Phosphorylierungsstellendatenbanken PhosPhAt 4.0 und P3DB Arabidopsis thaliana gefunden wurden.Mehr als die Hälfte der 82 identifizierten Phosphoproteine waren am Kohlenhydratstoffwechsel, an der Photosynthese/Atmung oder an Reaktionsmechanismen auf oxidativen Stress beteiligt.Die Anreicherung intakter Phosphoproteine vor 2-DE und LC-MS/MS scheint den Nachweis phosphorylierter Threonin- und Tyrosinreste im Vergleich zu Methoden, die eine Anreicherung auf Peptidebene nutzen, zu verbessern, was darauf hindeutet, dass die beiden Ansätze hinsichtlich der Abdeckung der Phosphorylierungsstellen einigermaßen komplementär sind.Durch den Vergleich der Ergebnisse für junge Sämlinge mit denen, die zuvor für reife Arabidopsis-Blätter erhalten wurden, wurden fünf Proteine identifiziert, die in diesen Geweben unterschiedlich phosphoryliert werden. Dies zeigt das Potenzial dieser Technik zur Untersuchung der Dynamik der Proteinphosphorylierung während der Pflanzenentwicklung.