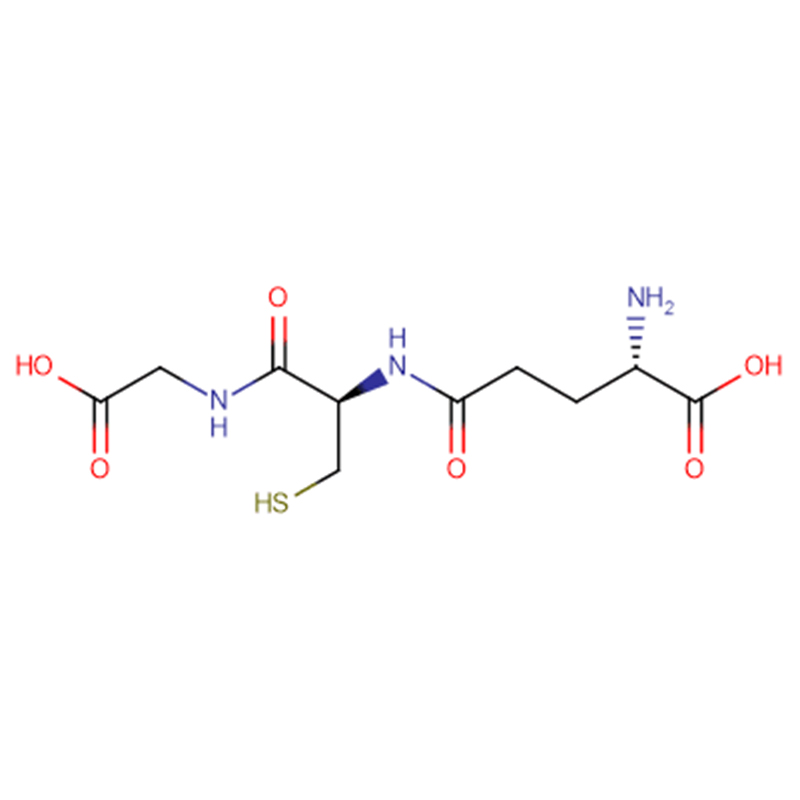
GSH Cas: 70-18-8 98 % Weißes kristallines Pulver
| Katalognummer | XD90227 |
| Produktname | GSH |
| CAS | 70-18-8 |
| Molekularformel | C10H17N3O6S |
| Molekulargewicht | 307.323 |
| Speicherdetails | 2 bis 8 °C |
| Harmonisierter Tarifkodex | 29309098 |
Produktspezifikation
| Produktspezifikation | |
| Schmelzpunkt | 185°C |
| Grad | Pharmaqualität |
| Schwermetalle | Maximal 10 ppm |
| Arsen | 2 ppm max |
| Identifikation | IR: Ähnlich mit dem Referenzspektrum |
| Trocknungsverlust | 0,5 % max |
| Lagertemperatur | +20 °C |
| Molekulargewicht | 612,63 |
| Test | 98,0 % min |
| Optische Drehung | -15,5°- -17,5 Grad |
| Glührückstand | 0,1 % max |
| Klarheit der Lösung | Klar und farblos |
| Aussehen | weißes kristallines Pulver |
| Verwandte Substanz | Gesamt: 2,0 % max., GSSG: 1,5 % max |
Das ORF45-Protein des Kaposi-Sarkom-assoziierten Herpesvirus (KSHV) ist ein Gammaherpesvirus-spezifisches Protein im unmittelbar frühen Tegument.Unsere früheren Studien haben seine entscheidende Rolle sowohl im frühen als auch im späten Stadium der KSHV-Infektion aufgezeigt.In dieser Studie haben wir das Interaktom von ORF45 mithilfe einer Reihe monoklonaler Antikörper untersucht.Zusätzlich zu den zuvor identifizierten Proteinen extrazelluläre regulierte Kinase (ERK) und p90-ribosomale S6-Kinase (RSK) fanden wir mehrere andere mitgereinigte Proteine, darunter prominente mit ∼38 kDa und ∼130 kDa.Massenspektrometrie ergab, dass es sich bei dem 38-kDa-Protein um virales ORF33 und bei dem 130-kDa-Protein um zelluläres USP7 (Ubiquitin-spezifische Protease 7) handelt.Wir haben die ORF33-Bindungsdomäne den hochkonservierten carboxylterminalen 19 Aminosäuren (aa) von ORF45 und die USP7-Bindungsdomäne dem gemeldeten Konsensmotiv in der zentralen Region von ORF45 zugeordnet.Mittels Immunfluoreszenzfärbung beobachteten wir die Kolokalisierung von ORF45 mit ORF33 oder USP7 sowohl unter transfizierten Bedingungen als auch in KSHV-infizierten Zellen.Darüber hinaus stellten wir eine ORF45-abhängige Relokalisierung eines Teils von ORF33/USP7 vom Zellkern in das Zytoplasma fest.Wir fanden heraus, dass ORF45 einen Anstieg der ORF33-Proteinakkumulation verursachte, der aufgehoben wurde, wenn entweder die ORF33- oder die USP7-Bindungsdomäne in ORF45 gelöscht wurde.Darüber hinaus führte die Deletion des konservierten Carboxylterminus von ORF45 im KSHV-Genom zu einer drastischen Reduzierung des ORF33-Proteinspiegels in KSHV-infizierten Zellen und einer Unterbindung der Produktion von Nachkommen-Virionen.Insgesamt enthüllen unsere Ergebnisse nicht nur neue Komponenten des ORF45-Interaktoms, sondern zeigen auch, dass die Wechselwirkungen zwischen diesen Proteinen für die lytische Replikation von KSHV entscheidend sind. Das Sarkom-assoziierte Herpesvirus von Kaposi (KSHV) ist der Erreger mehrerer Krebsarten beim Menschen.KSHV ORF45 ist ein multifunktionales Protein, das für die lytische Replikation von KSHV erforderlich ist. Die genauen Mechanismen, nach denen ORF45 seine entscheidenden Funktionen ausführt, sind jedoch unklar.Unsere früheren Studien haben gezeigt, dass das gesamte ORF45-Protein in Zellen in Komplexen mit hohem Molekulargewicht vorliegt.Wir haben daher versucht, das Interaktom von ORF45 zu charakterisieren, um Einblicke in seine Rolle während der lytischen Replikation zu gewinnen.Mithilfe einer Reihe monoklonaler Antikörper untersuchten wir das ORF45-Interaktom in KSHV-infizierten Zellen.Wir haben zwei neue Bindungspartner von ORF45 identifiziert: das virale Protein ORF33 und die zelluläre Ubiquitin-spezifische Protease 7 (USP7).Wir zeigen weiterhin, dass die Wechselwirkung zwischen ORF45 und ORF33 für die effiziente Produktion von KSHV-Viruspartikeln entscheidend ist, was darauf hindeutet, dass die gezielte Beeinträchtigung dieser Wechselwirkung eine neuartige Strategie zur Hemmung der lytischen Replikation von KSHV darstellen könnte.