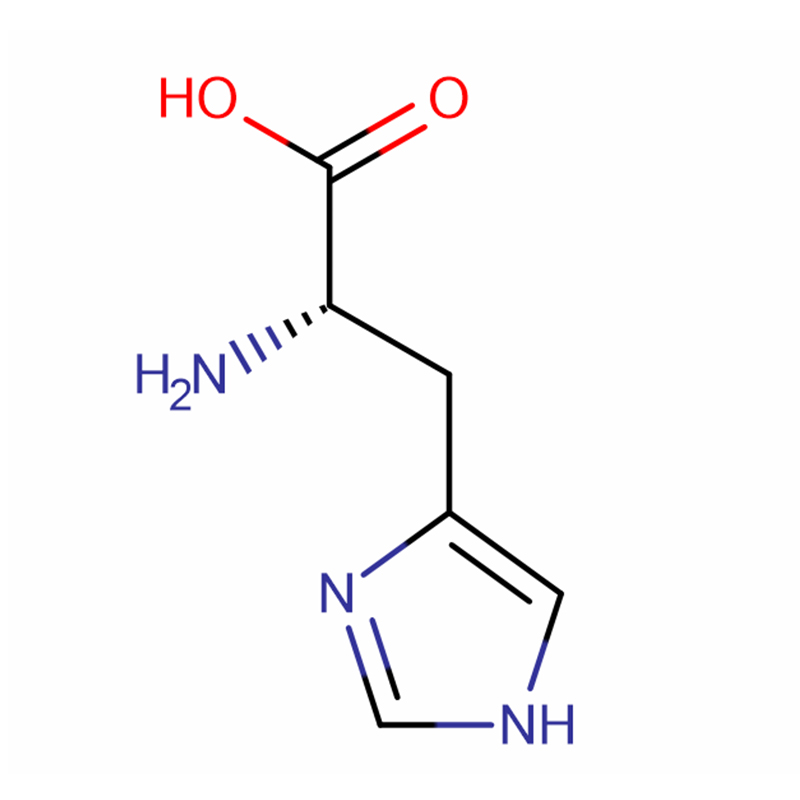
L-Histidin Cas: 71-00-1 98,5 % Weiße Kristalle oder kristallines Pulver
| Katalognummer | XD90301 |
| Produktname | L-Histidin |
| CAS | 71-00-1 |
| Molekularformel | C6H9N3O2 |
| Molekulargewicht | 155,15 |
| Speicherdetails | Umgebungs |
| Harmonisierter Tarifkodex | 29332990 |
Produktspezifikation
| Test | 98,5 % min |
| Aussehen | Weiße Kristalle oder kristallines Pulver |
| Grad | USP39 |
| Bestimmte Rotation | +12,6° bis +14,0° |
| Identifikation | Infrarotabsorption |
| pH | 7,0 - 8,5 |
| SO4 | <=0,03 % |
| Fe | <=30 ppm |
| Trocknungsverlust | <=0,2 % |
| Glührückstand | <=0,1 % |
| Cl | <=0,05 % |
| Schwermetalle (PB) | <=15 ppm |
| Verwandte Verbindungen | Es werden nicht mehr als 0,5 % einer einzelnen Verunreinigung gefunden;Es werden nicht mehr als 2,0 % der gesamten Verunreinigungen gefunden |
Die quadruplexbildenden G-reichen Sequenzen sind im menschlichen Genom ungleichmäßig verteilt.Ihre Anreicherung an onkogenen Promotoren und Telomeren hat das Interesse geweckt, G-Quadruplex (GQ) für eine Krebstherapie gezielt einzusetzen.Hier präsentieren wir eine quantitative Analyse der Konformationen und Dynamik von GQ-bildenden Sequenzen, gemessen durch Einzelmolekülfluoreszenz.Darüber hinaus beziehen wir diese Eigenschaften auf GQ-Targeting-Liganden und die Proteinbindung von G4-Resolvase 1 (G4R1).Unser Ergebnis zeigt, dass sowohl die Länge als auch die Sequenz der Schleife (Nicht-G-Komponenten) zur Konformation des GQ beitragen.Echtzeitspuren einzelner Moleküle zeigen, dass die Faltungsdynamik auch von der Schleifenzusammensetzung abhängt.Wir zeigen, dass GQ-stabilisierende kleine Moleküle, N-Methylmesoporphyrin IX (NMM), sein Analogon NMP und das G4R1-Protein, selektiv an die parallele GQ-Konformation binden.Unsere Ergebnisse deuten darauf hin, dass die Komplexität der GQ-Faltung von der Schleifenlänge und -sequenz bestimmt wird und wie die GQ-Konformation die Bindungsneigung kleiner Moleküle und Proteine bestimmt.