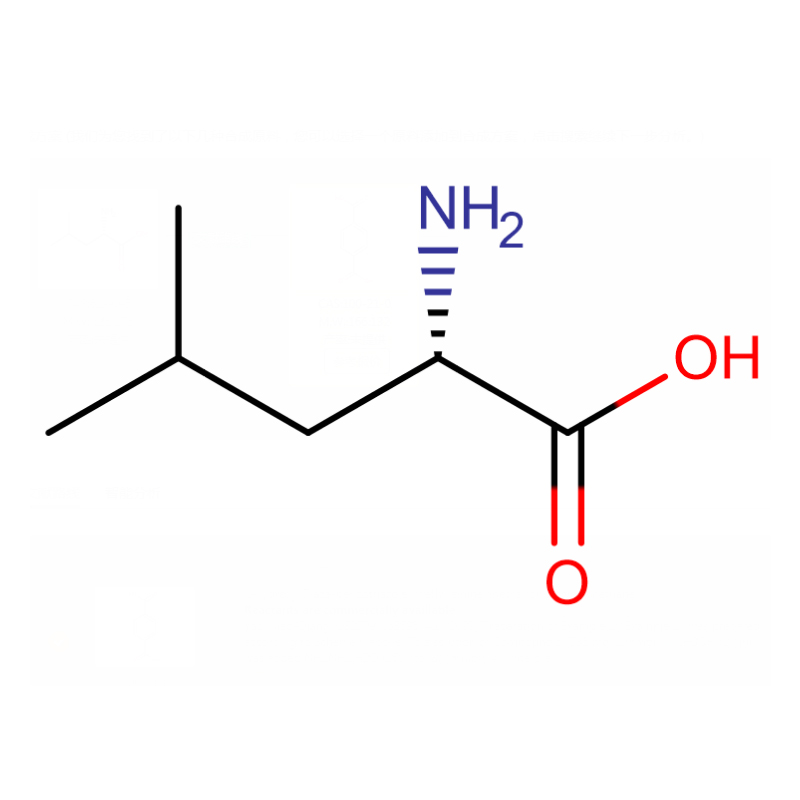
L-Leucin Cas: 61-90-5 99 % Weißes Pulver
| Katalognummer | XD90304 |
| Produktname | L-Leucin |
| CAS | 61-90-5 |
| Molekularformel | C6H13NO2 |
| Molekulargewicht | 131.17292 |
| Speicherdetails | Umgebungs |
| Harmonisierter Tarifkodex | 29224985 |
Produktspezifikation
Ähnlich wie andere Positivstrang-RNA-Viren werden Tombusviren durch den membrangebundenen viralen Replikasekomplex (VRC) repliziert.Der VRC besteht aus der p92-Virus-kodierten RNA-abhängigen RNA-Polymerase (RdRp), dem viralen p33-RNA-Chaperon und mehreren kooptierten Wirtsproteinen.Um nach seiner Translation zu einem funktionsfähigen RdRp zu werden, sollte das p92-Replikationsprotein in den VRC eingebaut und anschließend aktiviert werden.Wir haben zuvor in einem auf zellfreiem Hefeextrakt basierenden Assay gezeigt, dass die Aktivierung des Tomato Bushy Stunt Virus (TBSV) RdRp einen oder mehrere lösliche Wirtsfaktoren erfordert.In diesem Artikel identifizieren wir das zelluläre Hitzeschockprotein 70 (Hsp70) als den kooptierten Wirtsfaktor, der für die Aktivierung eines N-terminal verkürzten rekombinanten TBSV RdRp erforderlich ist.Darüber hinaus hemmt die auf kleinen Molekülen basierende Blockierung der Hsp70-Funktion die RNA-Synthese durch das Tombusvirus RdRp in vitro.Darüber hinaus zeigen wir, dass neutrale Phospholipide, nämlich Phosphatidylethanolamin (PE) und Phosphatidylcholin (PC), die RdRp-Aktivierung in vitro verstärken.Im Gegensatz dazu zeigt Phosphatidylglycerin (PG) eine starke und dominante Hemmwirkung auf die RdRp-Aktivierung in vitro.Wir zeigen auch, dass PE und PC die Interaktion zwischen RdRp und viraler Plusstrang-RNA [(+)RNA] stimulieren, während PG die Bindung der viralen RNA an RdRp hemmt.Basierend auf der stimulierenden bzw. hemmenden Rolle verschiedener Phospholipide bei der RdRp-Aktivierung des Tombusvirus schlagen wir vor, dass die Lipidzusammensetzung der gezielten subzellulären Membranen von Tombusviren genutzt werden könnte, um die Neubildung von VRC im Verlauf der Infektion zu regulieren. Die viruskodierte RNA-abhängige RNA-Polymerase (RdRp), das für die Synthese der viralen RNA-Nachkommen mehrerer Positivstrang-RNA-Viren in infizierten Zellen verantwortlich ist, ist zunächst inaktiv.Diese Strategie vermeidet wahrscheinlich die virale RNA-Synthese im Zytosol, die schnell zur Induktion RNA-ausgelöster zellulärer antiviraler Reaktionen führen würde.Während des Aufbaus des membrangebundenen Replikasekomplexes wird das virale RdRp durch einen noch nicht vollständig verstandenen Prozess aktiviert, der das RdRp zur RNA-Synthese befähigt.Durch die Verwendung von TBSV RdRp zeigen wir, dass das kooptierte zelluläre Hsp70-Chaperon und neutrale Phospholipide die RdRp-Aktivierung in vitro erleichtern.Im Gegensatz dazu hat Phosphatidylglycerin (PG) eine dominante Hemmwirkung auf die RdRp-Aktivierung in vitro und die Interaktion zwischen RdRp und viraler RNA, was darauf hindeutet, dass die membranöse Mikrodomäne, die das RdRp umgibt, seine Fähigkeit zur RNA-Synthese stark beeinflusst.Daher hängt die Aktivierung des viralen RdRp wahrscheinlich von mehreren Wirtskomponenten in infizierten Zellen ab.
4-Nitrophenyl-N-acetyl-β-D-glucosaminid ist ein nützliches Substrat für die schnelle kolorimetrische Bestimmung der N-Acetyl-b-glucosaminidase-Aktivität im menschlichen Urin.Chromogenes β-Glucosaminidase-Substrat, das bei der Spaltung eine gelbe Lösung ergibt und insbesondere in Hefen und Schimmelpilzen eingesetzt wird.