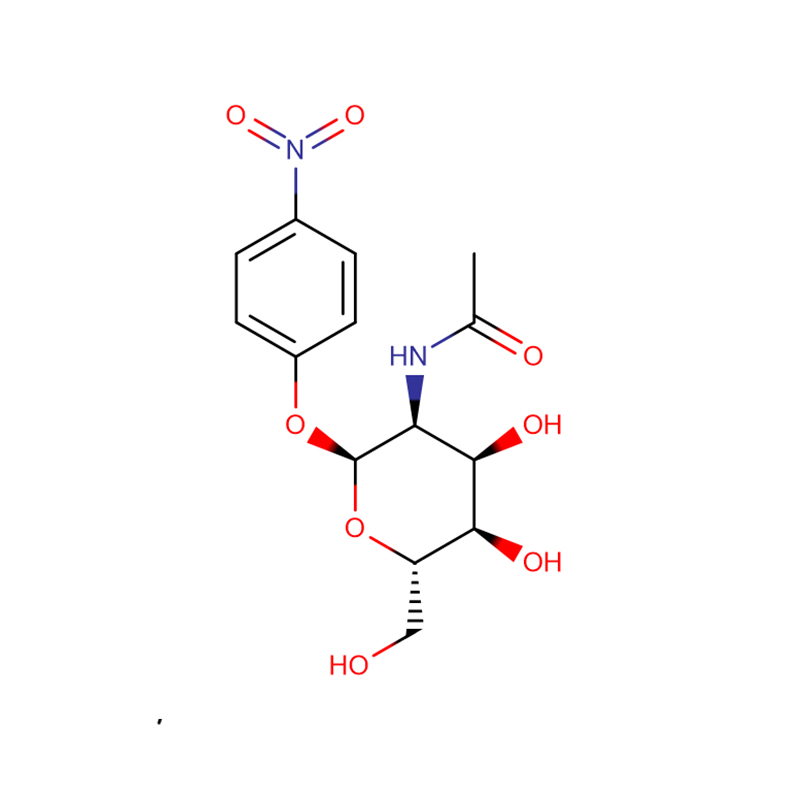
p-Nitrophenyl-aL-Fucopyranosid Cas:10231-84-2 Weißes bis hellgelbes kristallines Pulver
| Katalognummer | XD90142 |
| Produktname | p-Nitrophenyl-aL-Fucopyranosid |
| CAS | 10231-84-2 |
| Molekularformel | C12H15NO7 |
| Molekulargewicht | 285,25 |
| Speicherdetails | 2 bis 8 °C |
| Harmonisierter Tarifkodex | 29400000 |
Produktspezifikation
| Aussehen | Weißes bis hellgelbes kristallines Pulver |
| Assay | 99 % |
| TLC | Einzelplatz |
| Reinheits-HPLC | Min. 98 % |
| Löslichkeit (1 % in Wasser) | Klare, farblose Lösung |
| Dichte | 1,503 ± 0,06 g/cm3 (20 °C 760 Torr), |
| Schmelzpunkt | 196–197 °C |
| Siedepunkt | 515,4°Kat.760mmHg |
| Flammpunkt | 265,5°C |
| Brechungsindex | 1.623 |
LecA (PA-IL) ist ein zytotoxisches Lektin und Adhäsin, das von Pseudomonas aeruginosa produziert wird und hydrophobe Galaktoside mit hoher Spezifität und Affinität bindet.Mithilfe einer lecA-egfp-Translationsfusion und einer Immunoblot-Analyse der extrazellulären Biofilmmatrix zeigen wir, dass lecA in im Biofilm gewachsenen Zellen exprimiert wird.In statischen Biofilm-Assays sowohl auf Polystyrol als auch auf Edelstahl wurden die Tiefe und Oberflächenbedeckung des Biofilms durch die Mutation von lecA verringert und im LecA-überproduzierenden Stamm PAO-P47 verstärkt.Die Oberflächenbedeckung des Biofilms durch den Elternstamm PAO-P47, jedoch nicht durch die lecA-Mutante auf Stahlstücken, wurde auch durch das Wachstum in Gegenwart von Isopropyl-beta-D-thiogalactosid (IPTG) oder p-Nitrophenyl-alpha-D-galactosid gehemmt ( NPG).Darüber hinaus konnten reife Wildtyp-Biofilme, die in Abwesenheit dieser hydrophoben Galaktoside gebildet wurden, durch die Zugabe von IPTG dispergiert werden.Im Gegensatz dazu hatte die Zugabe von p-Nitrophenyl-alpha-L-fucose (NPF), das eine hohe Affinität zum P. aeruginosa LecB (PA-IIL)-Lektin aufweist, keinen Einfluss auf die Bildung oder Ausbreitung von Biofilmen.Das planktonische Wachstum von P. aeruginosa PAO1 wurde durch die Anwesenheit von IPTG, NPG oder NPF nicht beeinflusst, und der Stamm war auch nicht in der Lage, diese Zucker als Kohlenstoffquellen zu nutzen, was darauf hindeutet, dass die beobachteten Auswirkungen auf die Biofilmbildung auf die kompetitive Hemmung des LecA-Liganden zurückzuführen sind Bindung.Ähnliche Ergebnisse wurden auch für Biofilme erzielt, die unter dynamischen Strömungsbedingungen auf Stahlcoupons gezüchtet wurden, was darauf hindeutet, dass LecA unter verschiedenen Umweltbedingungen zur Biofilmarchitektur von P. aeruginosa beiträgt.
In den Blättern von Arabidopsis-Pflanzen wurde eine Alpha-L-Fucosidase (EC 3.2.1.51) nachgewiesen, die den t-Fucosylrest aus der Seitenkette von Xyloglucan-Oligosacchariden freisetzen kann.Darüber hinaus wurde eine Alpha-L-Fucosidase mit ähnlicher Substratspezifität aus Kohlblättern (Brassica oleracea) gereinigt, um eine einzelne Bande auf der SDS-PAGE zu ergeben.Aus dieser Proteinbande wurden zwei Peptidsequenzen erhalten, die zur Identifizierung eines Arabidopsis-Gens verwendet wurden, das für eine Alpha-Fucosidase kodiert, die wir AtFXG1 nennen möchten.Darüber hinaus wurde auch ein Arabidopsis-Gen mit Homologie zu bekannten Alpha-L-Fucosidasen gefunden, und wir haben vorgeschlagen, es als AtFUC1 zu bezeichnen.Sowohl AtFXG1 als auch ATFUC1 wurden heterolog in Pichia pastoris-Zellen exprimiert und die Alpha-L-Fucosidase-Aktivitäten wurden in das Kulturmedium sezerniert.Die von AtFXG1 kodierte Alpha-L-Fucosidase war gegen die Oligosaccharide von Xyloglucan XXFG sowie gegen 2'-Fucosyl-Lactitol aktiv, jedoch nicht gegen p-Nitrophenyl-Alpha-L-Fucopyranosid.Allerdings war das heterolog exprimierte AtFUC1 nur gegen 2'-Fucosyllactitol aktiv.Ersteres muss also mit dem Xyloglucan-Metabolismus zusammenhängen.