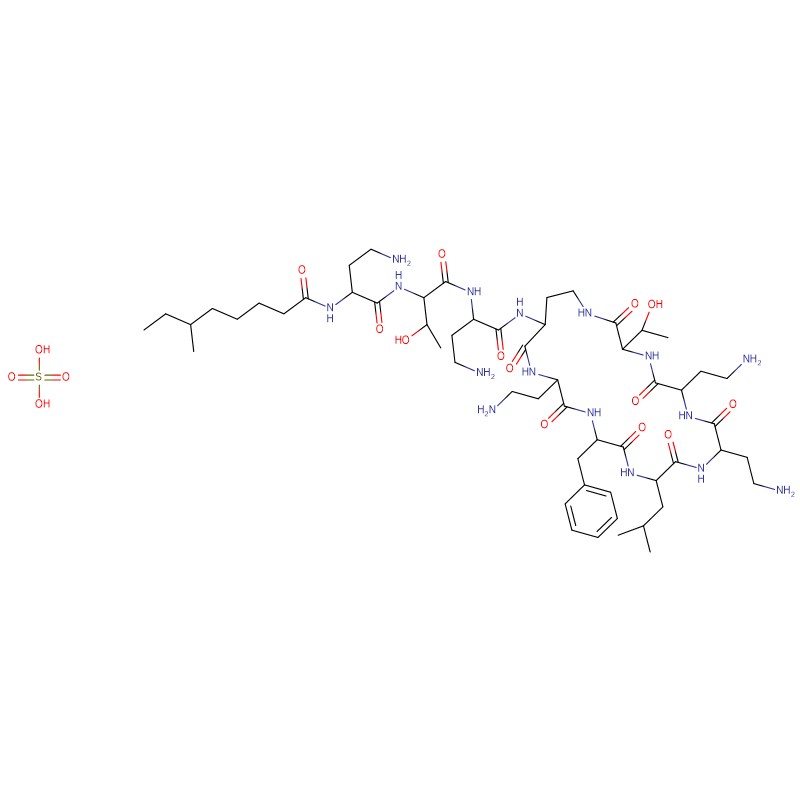
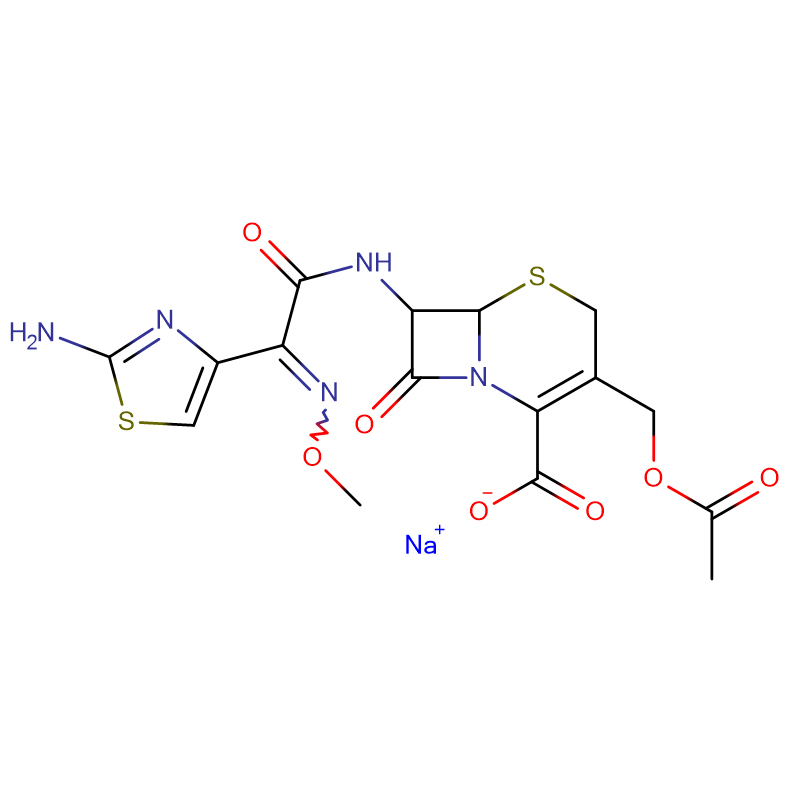
Polymyxin B-Sulfat CAS: 1405-20-5 Weißes Pulver
| Katalognummer | XD90360 |
| Produktname | Polymyxin B-Sulfat |
| CAS | 1405-20-5 |
| Molekularformel | C55H96N16O13 · 2H2SO4 |
| Molekulargewicht | 1385,61 |
| Speicherdetails | 2 bis 8 °C |
| Harmonisierter Tarifkodex | 29419000 |
Produktspezifikation
| Abschluss | Entspricht USP35 |
| Schwermetalle | <20 ppm |
| pH | 5-7 |
| Identifikation | Flüssigkeitschromatographie: entspricht |
| Test | 99 % |
| Aussehen | weißes Puder |
| Trocknungsverlust | <6 % |
| Löslichkeit | Frei löslich in Wasser, schwer löslich in Ethanol |
| Sulfat | 15,5 % – 17,5 % |
| Partikelgröße | <30µm |
| Spezifische optische Drehung | -78° -90° |
| Phenylalanin | 9,0 %–12,0 % |
| Pyrogene | Entspricht den Anforderungen |
| Sulfatasche | <0,75 % |
| Gesamte lebensfähige aerobe Zahl | <100 KBE/g |
| Potenz | >6500 IE/mg |
Das ExPortal-Proteinsekretionsorganell in Streptococcus pyogenes ist eine anionische Phospholipid-haltige Membranmikrodomäne, die mit Sec-Translokonen und Postsekretionsprotein-Biogenesefaktoren angereichert ist.Polymyxin B bindet an die ExPortal-Integrität und stört diese, was zu einer fehlerhaften Sekretion mehrerer Toxine führt.Um Einblick in Faktoren zu gewinnen, die die ExPortal-Organisation beeinflussen, wurde ein genetisches Screening durchgeführt, um spontane Polymyxin-B-resistente Mutanten auszuwählen, die eine verbesserte ExPortal-Integrität aufweisen.Die Neusequenzierung des gesamten Genoms von 25 resistenten Mutanten ergab ein bis vier Mutationen pro Mutantengenom, die hauptsächlich innerhalb eines Kernsatzes von 10 Gengruppen geclustert waren.Die Konstruktion von Mutanten mit einzelnen Deletionen oder Insertionen zeigte, dass 7 Kerngene durch Funktionsverlust Resistenz und erhöhte ExPortal-Integrität verleihen, während 3 wahrscheinlich auf Funktionsgewinn und/oder kombinatorische Effekte zurückzuführen sind.Zu den Kernresistenzgenen gehören ein Transkriptionsregulator der Lipidbiosynthese, mehrere Gene, die an der Nährstoffaufnahme beteiligt sind, und eine Vielzahl von Genen, die an Stressreaktionen beteiligt sind.Zwei Mitglieder der letzteren Klasse fungieren auch als neuartige Regulatoren der sekretierten SpeB-Cysteinprotease.Die Analyse der am häufigsten isolierten Mutation, einer einzelnen Nukleotiddeletion in einer Spur von 9 aufeinanderfolgenden Adeninresten in pstS, die eine Komponente eines hochaffinen Pi-Transporters kodiert, legt nahe, dass diese Sequenz als molekularer Schalter fungiert, um die Stressanpassung zu erleichtern.Zusammengenommen deuten diese Daten auf die Existenz einer Membranstressreaktion hin, die die Integrität und Resistenz von ExPortal gegenüber kationischen antimikrobiellen Peptiden fördert.