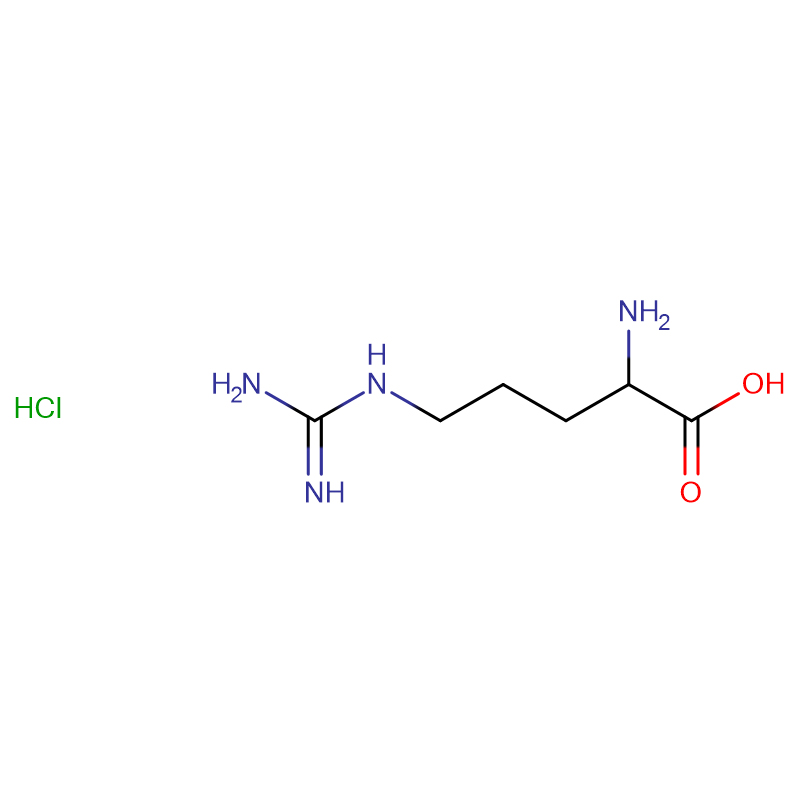
L-Arginin CAS:74-79-3 99 % Weiße Kristalle oder kristallines Pulver
| Katalognummer | XD90323 |
| Produktname | L-Arginin |
| CAS | 74-79-3 |
| Molekularformel | C6H14N4O2 |
| Molekulargewicht | 174,20 |
| Speicherdetails | Umgebungs |
| Harmonisierter Tarifkodex | 29252900 |
Produktspezifikation
| Aussehen | Weiße Kristalle oder kristallines Pulver |
| Test | 99 % |
| Identifikation | Infrarotabsorption |
| Trocknungsverlust | ≤ 0,5 % |
| Chromatographische Reinheit | Es werden nicht mehr als 0,5 % einer einzelnen Verunreinigung gefunden; es werden nicht mehr als 2,0 % der Gesamtverunreinigungen gefunden |
| Glührückstand | ≤ 0,3 % |
| Schwermetalle (PB) | ≤ 0,0015 % |
| Eisen (als Fe) | ≤ 0,003 % |
| Sulfat (als SO4) | ≤ 0,03 % |
| Usp-Klasse | USP 33 |
| Chlorid (CI) | ≤ 0,05 % |
| Spezifische Rotation [ α ] D 2 5 | +26,3° ~ +27,7° |
Der Mechanismus von Mycobacterium smegmatis G (MbsG), einer Flavin-abhängigen L-Lysin-Monooxygenase, wurde unter stationären und schnellen Reaktionsbedingungen untersucht, wobei primäre und lösungsmittelkinetische Isotopeneffekte, Substratanaloga, pH-Wert und Lösungsmittelviskositätseffekte als mechanistische Sonden verwendet wurden.Die Ergebnisse legen nahe, dass L-Lysin vor NAD(P)H bindet, was zu einer Verringerung der Geschwindigkeitskonstante für die Flavinreduktion führt.Die Bindung von L-Lysin hat keinen Einfluss auf die Geschwindigkeit der Flavinoxidation, die in einem einstufigen Prozess ohne die Beobachtung eines C4a-Hydroperoxyflavin-Zwischenprodukts erfolgt.Ähnliche Effekte wurden mit mehreren Substratanaloga festgestellt.Die Flavinoxidation ist pH-unabhängig, während die pH-Profile kcat/Km und kred/KD für NAD(P)H einzelne pKa-Werte von ∼6,0 aufweisen, wobei die Aktivität mit sinkendem pH zunimmt.Bei einem niedrigeren pH-Wert wird das Enzym stärker entkoppelt und produziert mehr Wasserstoffperoxid und Superoxid.Der Hydridtransfer ist bei neutralem pH-Wert teilweise geschwindigkeitsbestimmend und wird bei niedrigem pH-Wert noch geschwindigkeitsbestimmender.Bei neutralem pH-Wert wurde ein umgekehrter Lösungsmittelviskositätseffekt auf kcat/Km für NAD(P)H beobachtet, während bei niedrigerem pH-Wert ein normaler Lösungsmittelviskositätseffekt beobachtet wurde.Zusammengenommen weisen die Ergebnisse auf einen einzigartigen Mechanismus hin, bei dem in der reduktiven Halbreaktion eine geschwindigkeitsbestimmende und pH-empfindliche Konformationsänderung auftritt, die sich auf die Effizienz der Lysinhydroxylierung auswirkt.