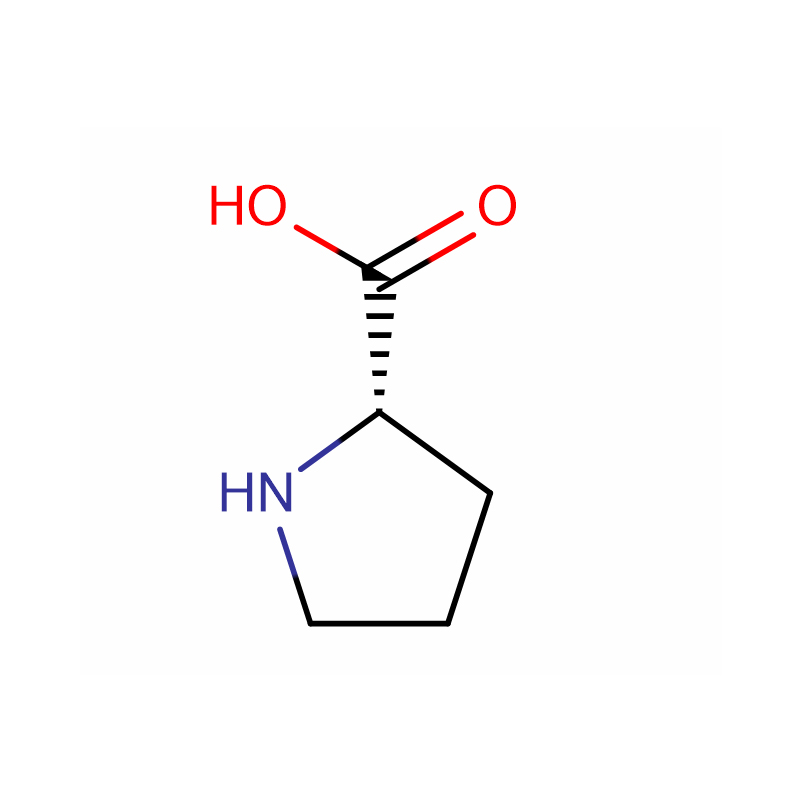
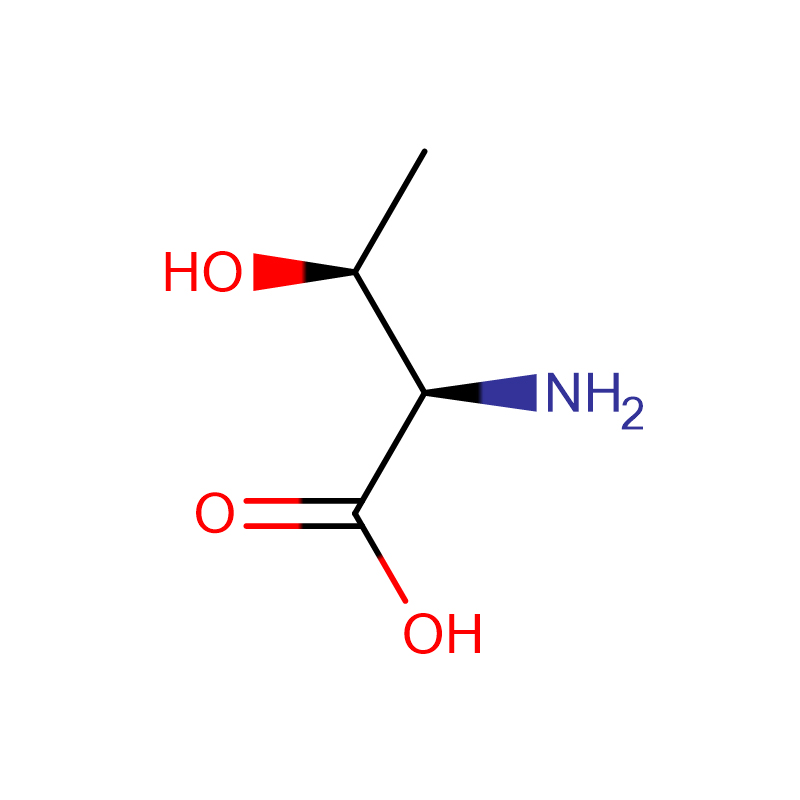
L-Prolin Cas: 147-85-3 99 % weißes Pulver
| Katalognummer | XD90293 |
| Produktname | L-Prolin |
| CAS | 147-85-3 |
| Molekularformel | C5H9NO2 |
| Molekulargewicht | 115.13046 |
| Speicherdetails | Umgebungs |
| Harmonisierter Tarifkodex | 29339980 |
Produktspezifikation
| Test | 99 % min |
| Aussehen | weißes Puder |
| Bestimmte Rotation | -84,5 bis -86 |
| Schwermetalle | <15 ppm |
| AS | <1 ppm |
| Ph | 5,9 - 6,9 |
| SO4 | <0,050 % |
| Fe | <30 ppm |
| Trocknungsverlust | <0,3 % |
| Glührückstand | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,050 % |
| Stand der Lösung | >98 % |
Das Verständnis des Stoffwechsels des mikrobiellen Wirts ist für die Entwicklung und Optimierung ganzzellbasierter biokatalytischer Prozesse von entscheidender Bedeutung, da es die Produktionseffizienz bestimmt.Dies gilt insbesondere für die Redox-Biokatalyse, bei der aufgrund der im Wirt endogenen Cofaktor-/Cosubstrat-Regenerationsfähigkeit metabolisch aktive Zellen eingesetzt werden.Rekombinante Escherichia coli wurden zur Überproduktion von Prolin-4-Hydroxylase (P4H) verwendet, einer Dioxygenase, die die Hydroxylierung von freiem L-Prolin zu trans-4-Hydroxy-L-Prolin mit a-Ketoglutarat (a-KG) als Cosubstrat katalysiert.In diesem Ganzzell-Biokatalysator stellt der zentrale Kohlenstoffstoffwechsel das erforderliche Cosubstrat a-KG bereit und koppelt die biokatalytische Leistung von P4H direkt an den Kohlenstoffstoffwechsel und die Stoffwechselaktivität.Durch die Anwendung sowohl experimenteller als auch computergestützter biologischer Werkzeuge wie Metabolic Engineering und (13)C-Stoffwechselflussanalyse ((13)C-MFA) untersuchten und quantifizierten wir die physiologische, metabolische und bioenergetische Reaktion des Ganzzell-Biokatalysators zur gezielten Biokonvertierung und identifizierte mögliche metabolische Engpässe für eine weitere rationale Signalwegentwicklung. Ein E. coli-Stamm mit Prolinabbaudefizienz wurde durch Deletion des putA-Gens, das für die Prolindehydrogenase kodiert, konstruiert.Ganzzellige Biotransformationen mit diesem Mutantenstamm führten nicht nur zu einer quantitativen Prolinhydroxylierung, sondern auch zu einer Verdoppelung der spezifischen trans-4-L-Hydroxyprolin (hyp)-Bildungsrate im Vergleich zum Wildtyp.Die Analyse des Kohlenstoffflusses durch den Zentralstoffwechsel des Mutantenstamms ergab, dass der erhöhte a-KG-Bedarf für die P4H-Aktivität den a-KG-erzeugenden Fluss nicht steigerte, was auf einen streng regulierten TCA-Zyklusbetrieb unter den untersuchten Bedingungen hinweist.Im Wildtyp-Stamm führten die P4H-Synthese und -Katalyse zu einer Verringerung des Biomasseertrags.Interessanterweise kompensierte der ΔputA-Stamm zusätzlich den damit verbundenen ATP- und NADH-Verlust, indem er den Erhaltungsenergiebedarf bei vergleichsweise niedrigen Glukoseaufnahmeraten reduzierte, anstatt die TCA-Aktivität zu erhöhen. Es wurde festgestellt, dass der putA-Knockout in rekombinantem E. coli BL21(DE3)(pLysS) dies bewirkt nicht nur im Hinblick auf die Biotransformationsausbeute, sondern auch hinsichtlich der Biotransformations- und Prolinaufnahmeraten sowie der Hyp-Ausbeute an der Energiequelle vielversprechend für eine produktive P4H-Katalyse sein.Die Ergebnisse deuten darauf hin, dass nach einem putA-Knockout die Kopplung des TCA-Zyklus an die Prolinhydroxylierung über das Cosubstrat a-KG zu einem Schlüsselfaktor und Ziel für die weitere Verbesserung der Effizienz a-KG-abhängiger Biotransformationen wird.