IPTG (Isopropyl-β-D-thiogalactosid) ist ein Analogon des β-Galactosidase-Substrats, das hoch induzierbar ist.Unter der Induktion von IPTG kann der Induktor einen Komplex mit dem Repressorprotein bilden, wodurch sich die Konformation des Repressorproteins ändert, so dass es nicht mit dem Zielgen kombiniert werden kann und das Zielgen effizient exprimiert wird.Wie soll also die Konzentration von IPTG während des Experiments bestimmt werden?Ist je größer desto besser?
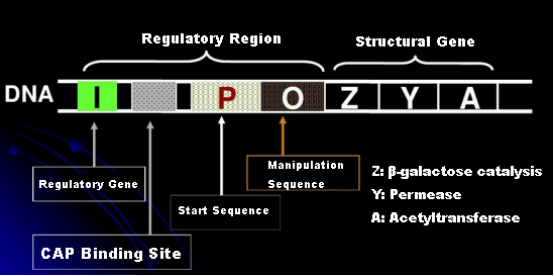
Lassen Sie uns zunächst das Prinzip der IPTG-Induktion verstehen: Das Lactose-Operon (Element) von E. coli enthält drei Strukturgene, Z, Y und A, die jeweils für β-Galactosidase, Permease und Acetyltransferase kodieren.lacZ hydrolysiert Laktose zu Glucose und Galactose oder zu Allo-Lactose;lacY ermöglicht, dass Laktose in der Umgebung die Zellmembran passiert und in die Zelle gelangt;lacA überträgt die Acetylgruppe von Acetyl-CoA auf β-Galactosid, wodurch die toxische Wirkung beseitigt wird.Darüber hinaus gibt es eine Betriebssequenz O, eine Startsequenz P und ein regulatorisches Gen I. Der I-Gencode ist ein Repressorprotein, das an die Position O der Operatorsequenz binden kann, so dass das Operon (Meta) unterdrückt wird und ausgeschaltet.Es gibt auch eine Bindungsstelle für das katabolische Genaktivatorprotein-CAP-Bindungsstelle stromaufwärts der Startsequenz P. Die P-Sequenz, die O-Sequenz und die CAP-Bindungsstelle bilden zusammen die regulatorische Region des Lac-Operons.Die kodierenden Gene der drei Enzyme werden von derselben regulatorischen Region reguliert, um die koordinierte Expression von Genprodukten zu erreichen.
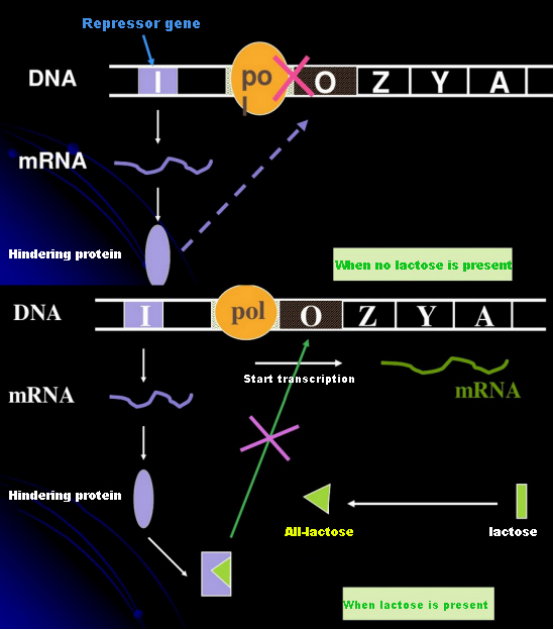
In Abwesenheit von Laktose befindet sich das Lac-Operon (Meta) in einem Zustand der Unterdrückung.Zu diesem Zeitpunkt bindet der von der I-Sequenz unter der Kontrolle der PI-Promotorsequenz exprimierte Lac-Repressor an die O-Sequenz, wodurch die Bindung der RNA-Polymerase an die P-Sequenz verhindert und die Transkriptionsinitiierung gehemmt wird.Wenn Laktose vorhanden ist, kann das Lac-Operon (Meta) induziert werden. In diesem Operon-System (Meta) ist der eigentliche Induktor nicht die Laktose selbst.Laktose gelangt in die Zelle und wird durch β-Galaktosidase katalysiert, um in Allolaktose umgewandelt zu werden.Letzteres bindet als Induktormolekül an das Repressorprotein und verändert die Proteinkonformation, was zur Dissoziation des Repressorproteins von der O-Sequenz und zur Transkription führt.Isopropylthiogalactosid (IPTG) hat die gleiche Wirkung wie Allolactose.Es ist ein sehr starker Induktor, der von Bakterien nicht verstoffwechselt wird und sehr stabil ist, weshalb es in Laboratorien häufig verwendet wird.
Wie ermittelt man die optimale IPTG-Konzentration?Nehmen Sie als Beispiel E. coli.
Der gentechnisch veränderte Stamm E. coli BL21, der das positive rekombinante pGEX (CGRP/msCT) enthielt, wurde in LB-Flüssigmedium mit 50 μg·ml-1 Amp inokuliert und über Nacht bei 37 °C kultiviert.Die obige Kultur wurde in 10 Flaschen mit 50 ml frischem LB-Flüssigmedium mit 50 μg·ml-1 Amp in einem Verhältnis von 1:100 für die Expansionskultur inokuliert, und als der OD600-Wert 0,6–0,8 betrug, wurde IPTG bis zur Endkonzentration hinzugefügt.Sie beträgt 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.Nach der Induktion bei der gleichen Temperatur und zur gleichen Zeit wurde 1 ml der Bakterienlösung entnommen, die Bakterienzellen durch Zentrifugation gesammelt und einer SDS-PAGE unterzogen, um den Einfluss verschiedener IPTG-Konzentrationen auf die Proteinexpression zu analysieren Wählen Sie die IPTG-Konzentration mit der größten Proteinexpression.
Nach Experimenten wird festgestellt, dass die IPTG-Konzentration nicht so hoch wie möglich ist.Dies liegt daran, dass IPTG eine gewisse Toxizität für Bakterien aufweist.Eine Überschreitung der Konzentration führt ebenfalls zur Abtötung der Zelle;und im Allgemeinen hoffen wir, dass es umso besser ist, je mehr lösliches Protein in der Zelle exprimiert wird, aber in vielen Fällen wird, wenn die IPTG-Konzentration zu hoch ist, eine große Menge an Einschlüssen gebildet.Körper, aber die Menge an löslichem Protein nahm ab.Daher ist die am besten geeignete IPTG-Konzentration oft nicht je höher, desto besser, sondern je niedriger die Konzentration.
Der Zweck der Induktion und Kultivierung gentechnisch veränderter Stämme besteht darin, die Ausbeute des Zielproteins zu erhöhen und die Kosten zu senken.Die Expression des Zielgens wird nicht nur durch die stammeigenen Faktoren und das Expressionsplasmid beeinflusst, sondern auch durch andere äußere Bedingungen, wie die Konzentration des Induktors, die Induktionstemperatur und die Induktionszeit.Daher ist es im Allgemeinen am besten, vor der Expression und Reinigung eines unbekannten Proteins die Induktionszeit, die Temperatur und die IPTG-Konzentration zu untersuchen, um die geeigneten Bedingungen auszuwählen und die besten experimentellen Ergebnisse zu erzielen.
Zeitpunkt der Veröffentlichung: 31. Dezember 2021

